以下のテーマについて研究活動を行っている。
【概要】
脊髄損傷患者数は、全世界で250万人とされ、多くの患者が障害を抱え不自由な生活と苦難を強いられている。脊髄損傷の麻痺の軽減に向けての基礎的研究の進歩は目覚しいが、損傷時の脊髄細胞障害と再生阻害の詳細なメカニズムについては未だ解明されていない点が多い。外傷性脊髄損傷後、当初直接外力を受けた部位に限局していた損傷は時間の経過とともに拡大する。この損傷範囲拡大、すなわち2次損傷の主体の一つとなるのがグリア細胞のアポトーシスによる脱髄の進行である。また脊髄損傷後、損傷部周囲でオリゴデンドロサイト前駆細胞は増殖するものの、そのほとんどは成熟細胞へと分化することなくアポトーシスにより消失し、脊髄損傷後の再髄鞘形成障害の重要な要因となっている。この2次損傷における脱髄、および損傷後の再髄鞘形成障害におけるグリア細胞のアポトーシスには小胞体ストレスが密接に関与している。つまり小胞体ストレスのコントロールが可能であれば、アポトーシスの抑制により2次損傷による損傷範囲拡大の抑制とオリゴデンドロサイト前駆細胞の生存による再髄鞘化から脊髄損傷後の遺残麻痺の軽減へとつながる可能性がある。われわれの研究室では脊髄損傷後の損傷範囲拡大と再髄鞘形成障害の原因となるオリゴデンドロサイト前駆細胞の細胞死、および細胞死の重要な因子である小胞体ストレスに着目しその解析と再髄鞘化による新たな脊髄損傷治療の研究を行っている。
【これまでの報告】
(1)小胞体ストレス経路における細胞保護因子GRP78の遺伝子導入により小胞体ストレス下での培養グリア細胞のアポトーシスが抑制された (Neuroscience Letters, 2011)
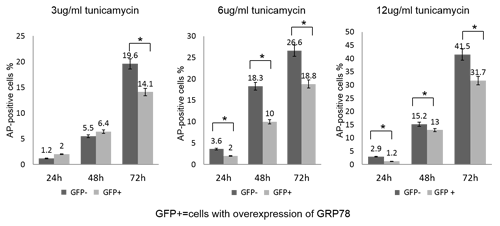
GRP78遺伝子導入による小胞体ストレス下での細胞死の比較
(2)オリゴデンドロサイト前駆細胞は脊髄損傷後の細胞保護因子GRP78発現が低く、アポトーシス促進因子CHOPの発現は高く、他細胞腫と比較して小胞体ストレス耐性が低い。
(Spinal Cord, 2014)
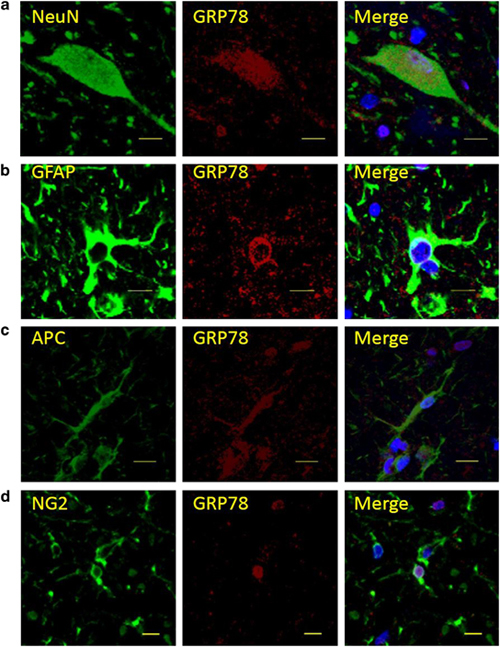
損傷脊髄内での各細胞腫におけるGRP78の発現。
NueN=neuron, GFAP=astrocyte, APC=oligodendorocyte, NG2=oligodendrocyte precursor cell
(3)培養グリア細胞へのGRP78遺伝子導入は、生体内で小胞体ストレスの原因となる酸化ストレスに対しても細胞保護効果を示した。(PLOS one, 2014)
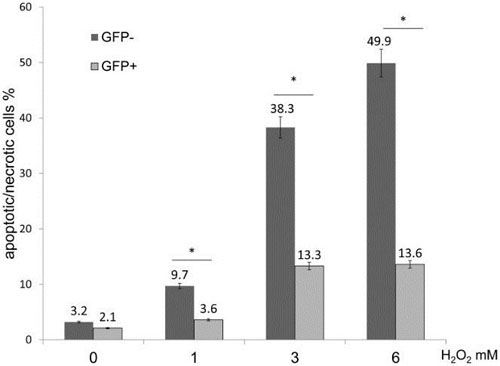
GRP78遺伝子導入による酸化ストレス下での細胞死の比較
(4)ラット脊髄損傷モデルへの小胞体ストレス調節薬剤アミロライドの投与により、損傷脊髄内での細胞死の抑制およびオリゴデンドロサイト前駆細胞の生存を認めた。(European Journal of Neuroscience, 2014)
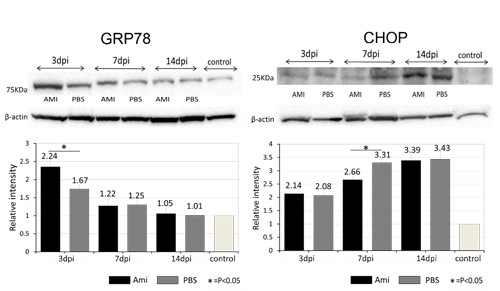
アミロライド投与による細胞保護因子GRP78発現増加と細胞死促進因子CHOPの発現低下
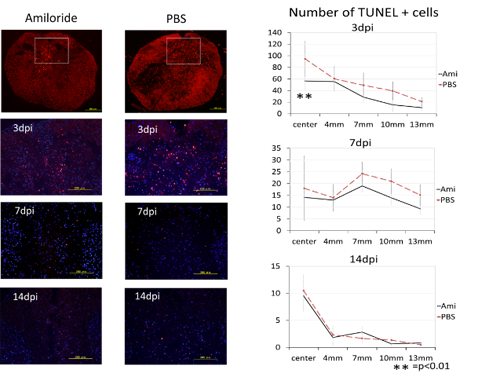
アミロライド投与によるラット損傷脊髄内での細胞死抑制
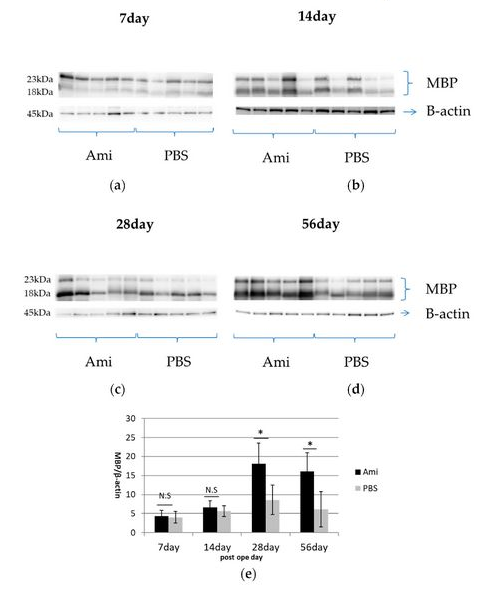
(5)脊髄損傷ラットにアミロライドを使用し、ミエリン塩基性タンパク質(MBP)発現レベルの増加が観察され、成熟オリゴデンドロサイトの数の増加が髄鞘形成の改善につながった可能性が示唆された。(Journal of Clinical Medicine,2018)
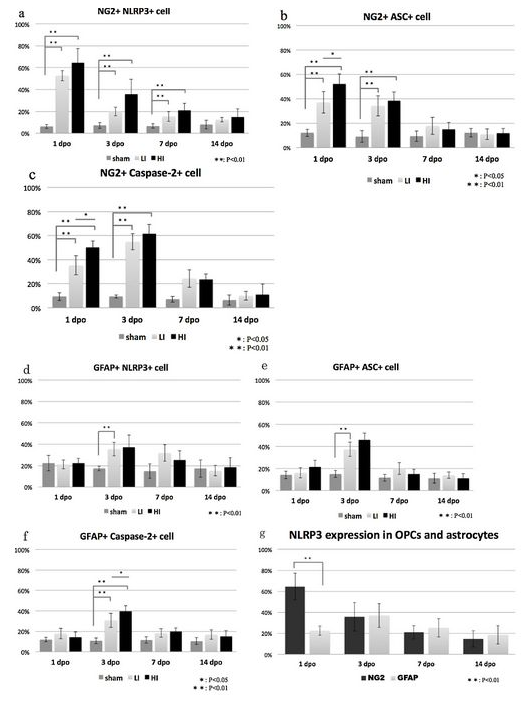
(6)インフラマソームの発現は、ERストレスの増加に関連して脊髄損傷後に増加する。 OPC細胞死に関連している可能性があるアストロサイトと比較して、脊髄損傷後のOPCにはインフラマソームのタンパク質発現が有意に高かった。(Neuroscience Letters,2019)
【業績】